「コバス® EGFR 変異検出キット v2.0」EGFR遺伝子検査(血漿)の保険収載
- ロシュ・ダイアグノスティックス株式会社
- 2017年6月30日
ロシュ・ダイアグノスティックス株式会社(本社:東京都港区/代表取締役社長 兼 CEO:小笠原 信)は、2016年12月26日に一部変更承認(適応追加)を取得した「コバス® EGFR 変異検出キット v2.0」のEGFR T790M血漿検査が、6月28日の中医協総会で審議され、7月1日付保険適用が承認されたことをお知らせします。
「コバス® EGFR変異検出キット v2.0」は、ゲノムDNA中のEGFR遺伝子変異を定性的に検出するキットです。非小細胞肺がん治療において、EGFRチロシンキナーゼ阻害剤(EGFR-TKI)投与前の初回検査に使用します。また、EGFR-TKIに薬剤耐性を示した患者のEGFR T790M変異を検出する際に、アストラゼネカ株式会社の非小細胞肺がん治療薬「タグリッソ®錠40mg/80mg」(一般名:オシメルチニブメシル酸塩)のコンパニオン診断薬として使用します。本キットは、組織検体で既に保険適用されていますが、今回、EGFR 遺伝子検査(血漿)として、新たに血漿検査が保険適用されることになります。これにより、それまで組織検体による遺伝子検査が実施できなかった患者さんに、低侵襲の検査を保険診療により提供できることとなりました。当社では、患者さんの治療へのアクセスがさらに改善されるよう、一日も早い保険適用へ向けて尽力してまいりました。
今回の保険適用が、患者さんの適切な治療選択にさらに貢献できることを期待します。
【保険収載の内容】
区分:E3 (改良項目)
測定項目:EGFR 遺伝子検査(血漿)
測定方法:アレル特異的リアルタイムPCR法
主な測定目的:癌組織又は血漿から抽出したゲノムDNA中のEGFR 遺伝子変異(T790M)の検出(オシメルチニブメシル酸塩の非小細胞肺癌患者への適応を判定するための補助に用いる)
保険点数:2,100点
留意事項:
1.本検査は、肺癌の再発や増悪により、EGFR 遺伝子変異の2次的遺伝子変異が疑われ、再度治療法を選択する必要があり、血漿を用いてリアルタイムPCR法で測定した場合に、患者1人につき1回に限り算定できる。ただし、本検査の実施は、医学的な理由により、肺癌の組織を検体として、区分番号「D004-2」悪性腫瘍組織検査の「1」悪性腫瘍遺伝子検査の「イ」EGFR 遺伝子検査(リアルタイムPCR法)又は「ロ」EGFR 遺伝子検査(リアルタイムPCR法以外)を行うことが困難な場合に限る。本検査の実施にあたっては、関連学会が定める実施指針を遵守すること。
2.本検査を実施した場合には、肺癌の組織を検体とした検査が実施困難である医学的な理由を診療録及び診療報酬明細書の摘要欄に記載すること。
3.本検査、区分番号「D004-2」悪性腫瘍組織検査の「1」悪性腫瘍遺伝子検査、区分番号「D006-2」造血器腫瘍遺伝子検査又は区分番号「D006-6」免疫関連遺伝子再構成のうちいずれかを同一月中に併せて行った場合には、主たるもののみ算定する。
【本品で承認・保険適用を受けている検体種と検査】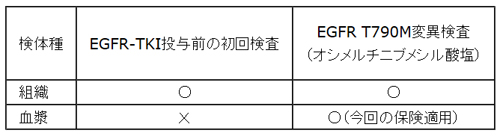
【タグリッソ®について】
「タグリッソ®錠40mg/80mg」(一般名:オシメルチニブメシル酸塩、以下、タグリッソ®)は、「EGFRチロシンキナーゼ阻害薬に抵抗性のEGFR T790M変異陽性の手術不能又は再発非小細胞肺癌」を効能・効果として、2016年3月28日にアストラゼネカが国内製造販売承認を取得し、同年5月25日より販売を開始した抗悪性腫瘍剤/チロシンキナーゼ阻害剤です。第III相国際臨床試験(AURA3試験)における標準的化学療法との比較において有意にPFSを延長したことから、「肺癌診療ガイドライン2016年版」(日本肺癌学会発行)において、推奨グレードAとして掲載されています。 タグリッソ®は、これまで、米国・欧州を含む40ヵ国以上で承認を取得しています。
【お問い合わせ先】
広報グループ(報道関係者向け)
03-6634-1062
医療関係者の方
カスタマーサポートセンター
0120-600-152
- 企業サイトURL
- http://www.roche-diagnostics.jp/
- ニュース・プレスリリース
- http://www.roche-diagnostics.jp/news/17/06/30.html
最新ニュース・プレスリリース
- 【ロシュ・ダイアグノスティックス株式会社】ロシュ・ダイアグノスティックス、質量分析の分野に参入 フルオートメーションの装置で、検査室に革新をもたらす (2025-04-10)
- 【ロシュ・ダイアグノスティックス株式会社】アルツハイマー病の原因となる脳内アミロイドβ濃度を脳脊髄液から調べる検査薬、体外診断用医薬品として製造販売承認を取得 (2025-03-21)
- 【ロシュ・ダイアグノスティックス株式会社】ミスマッチ修復機能欠損判定検査に用いる免疫組織化学染色4項目 子宮体癌患者へのリムパーザ®の投与前検査で保険適用 (2025-02-03)
- 【ロシュ・ダイアグノスティックス株式会社】「ベンタナ OptiView CINtec p16(E6H4)」 子宮頸部上皮内腫瘍の新たな診断補助として保険適用、新発売のお知らせ (2025-01-14)
- 【ロシュ・ダイアグノスティックス株式会社】ロシュ・ダイアグノスティックスとタウンズの取引基本契約に関する基本合意書締結のお知らせ (2024-12-25)


